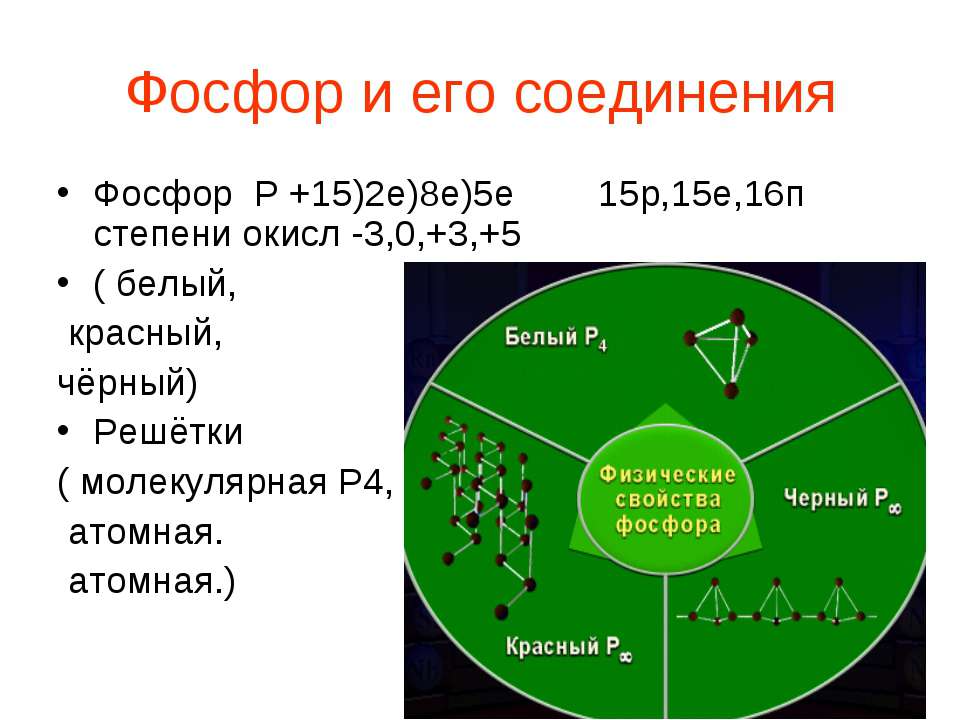
Железо и его соединения

- Рубрика: Презентации / Презентации по Химии
- Просмотров: 490
Презентация "Железо и его соединения" онлайн бесплатно на сайте электронных школьных учебников edulib.ru
Железо расположено в 4 периоде, в побочной подгруппе VIII группы Периодической системы химических элементов Д.И.Менделеева. Относительная атомная масса – 56.
Строение атома: +26)2)8)14)2. Электронная формула строения атома: 1s 2s 2p 3s 3p 3d 4s . В отличие от металлов главных подгрупп (s-элементов), в атомах которых заполняются электронами s-подуровни внешнего слоя в атоме железа происходит заполнения d-уровня второго снаружи слоя. Поэтому железо относится к d – элементам и проявляет переменную валентность (II) и (III). 2 2 6 2 6 6 2
Распространение в природе: По распространенности в природе железо стоит на 4 месте после кислорода, кремния и алюминия. Содержание железа в земной коре 5% (масс). Природные соединения железа – магнетит Fe O гематит Fe O лимонит Fe O nH O, пирит FeS сидерит FeCO . В состав минеральных вод в природе железо входит в виде сульфата и гидрокарбоната. В живых организмах оно присутствует в составе гемоглобина крови, участвует в транспортировке кислорода. 3 4 . 2 3 2 3 2 2 3
Получения Железа: Железо получают в виде сплава восстановлением из его соединений при высоких температурах в доменных печах.
Физические свойства: Чистое железо серебристо-белый пластичный металл. Плотность железа 7,87г/см , оно плавится при температуре 1539 С и легко намагничивается. 3 о
Химические свойства: Железо вступает в химические реакции как металл средней активности. Отдавая электроны внешнего уровня, железо окисляется до степени окисления , равной +2. До степени окисления , равной +2, железо окисляется, взаимодействуя со слабыми окислителями. Реакция взаимодействия порошка железа с серой при нагревании: +2 -2 Fe0 + S0 = Fe Fe
Так же происходят реакции замещения между железом и разбавленными кислотами: Fe0+H2SO4 FeSO4 + H2 (разбавл.) Железо вытесняет медь из растворов солей и окисляется до +2: Fe + CuSO4 = FeSO4 + Cu Хлор – сильный окислитель , он окисляет железо до степени окисления, равной +3: +3 -1 2Fe+3Cl2=2FeCl3
Железо горит в кислороде с треском, разбрасывает искры и окисляется до+2 и +3: 3Fe+2O2 = Fe3O4 Соединения железа. Железо образует два ряда кислородных соединений: FeO Fe(OH)2 FeSO4 Fe2O3 Fe(OH)3 Fe2(SO4)3 И оксиды, и гидроксиды железа в воде не растворяются. При добавлении щелочи в раствор сульфата железа (II) выпадает белый осадок: FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
На воздухе беловатый осадок становится зеленоватым, а затем – бурым, так как ионы Fe2+ окисляются до Fe3+: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Гидроксид железа (II), растворяясь в кислотах, проявляет основные свойства: Fe(OH)2 +2HCl = FeCl2 + 2H2O Гидроксид железа (III) также получают действием щелочи на раствор соли железа (III): Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 +3Na2SO4
Гидроскид железа (III) растворяется в кислотах ,проявляя основные свойства: Fe(OH)3 +3HCl = FeCl3 + 3H2O Гидроскид железа (III) при нагревании разлагается: 2Fe(OH)3 = Fe2O3 + 3H2O Железо с углеродом образует химическое соединение – Цементит, Fe3C. При добавлении в сплав железа и углерода незначительного количества хрома, марганца, никеля , меди и т.д. качество сплава улучшается.
Самый распространенный после алюминия на земном шаре металл – железо. Соединения: гематит Fe2O3, магнетит Fe3O4, сидерит FeCO3, пирит FeS2 и т.д. Железо взаимодействует с неметаллами, растворами кислот и солей. В своих соединениях железо проявляет степень окисления +2,+3 и, соответственно, образует два ряда соединений