Презентация к уроку "Соединения серы"
- Рубрика: Презентации / Другие презентации
- Просмотров: 262
Презентация "Презентация к уроку "Соединения серы"" онлайн бесплатно на сайте электронных школьных учебников edulib.ru
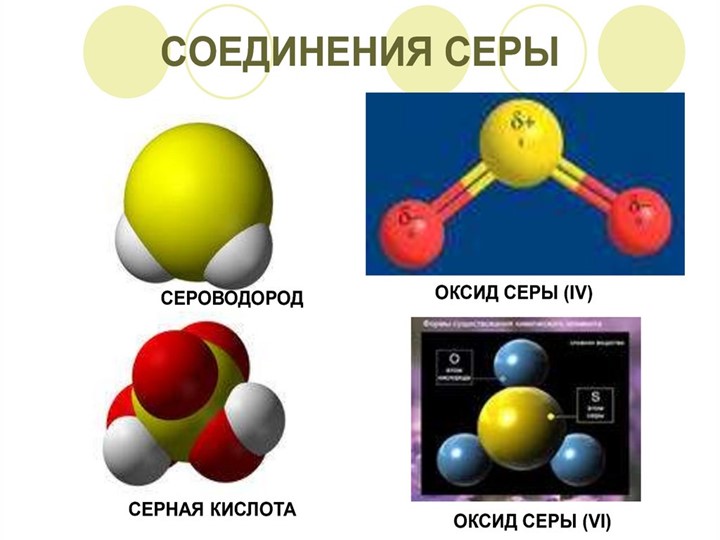
Соединения серы
1.Какие степени окисления характерны для серы?
2.Какие соединения серы в этих с.о. вам известны?
Сероводород
Химические свойства:
H2S -сильный восстановитель!!!!
H2S окисляется до S, SО2, H2SO4
1.Кислородом воздуха:
H2S + О2(избыток) = … + Н2О- ОВР!!!
H2S + О2(недостаток) = … + Н2О- ОВР!!!
Сероводород
2.С галогенами:
H2S + Cl2 → 2HCl + S↓
H2S + Cl2 + H2O → … + …
3.С кислотами-окислителями:
H2S + H2SO4(конц.) = … + … + Н2О
4.С солями сильных кислот , если сульфид ↓:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3 -качественная реакция!!!!
Сульфиды
Сульфиды – это бинарные соединения серы с элементами с меньшей электроотрицательностью, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
По растворимости в воде и кислотах сульфиды классифицируют на:
растворимые в воде — сульфиды щелочных металлов и аммония;
нерастворимые в воде, но растворимые в минеральных кислотах — сульфиды металлов, расположенных до железа в ряду активности (белые и цветные сульфиды ZnS, MnS, FeS, CdS);
нерастворимые ни в воде, ни в минеральных кислотах — черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS)
гидролизуемые водой — сульфиды трехвалентных металлов (алюминия и хрома (III))
Сульфиды
1.Гидролизуются:
Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
Подвергаются обжигу:
ZnS + O2 = … + …
CuS + O2 → … + …
Оксид серы (IV)
диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Физические свойства сернистого газа
При обычной температуре SO2 — газ с резким запахом без цвета. В воде растворим хорошо — при 20°С в 1 л воды растворяется 40 л SO2.
SO2 - промежуточная с.о.
восстановитель!!!!
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Окислитель!!! С сильными восстановителями:
SO2 + 2Н2S → 3S↓ + 2H2O
Оксид серы (VI)
триоксид серы, серный ангидрид (SO3)
Получение:
2SO2 + O2 ↔ 2SO3
Разложением сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
При обычных условиях SO3 -бесцветная жидкость с характерным резким запахом. На воздухе SO3 «дымит» и сильно поглощает влагу.
SO3 – тяжелее воздуха, хорошо растворим в воде.
SO3 ядовит!